Удивительные свойства воды


Средняя оценка: 4.3
Всего получено оценок: 238.
Средняя оценка: 4.3
Всего получено оценок: 238.
Из курса физики 7 класса известно, что вода — это вещество, имеющее исключительно важное значение для Земли. Облик нашей планеты и сама жизнь на ней определяется наличием воды во всех трёх агрегатных состояниях. Поговорим об удивительных свойствах воды, позволивших ей стать настолько важной для нашего существования.
Молекула воды
Молекула воды — это соединение двух атомов водорода с одним атомом кислорода. В электронной оболочке атома водорода один электрон, а во внешней оболочке атома кислорода — шесть электронов. Двум атомам водорода «энергетически выгодно» объединить свои оболочки с атомом кислорода, в результате чего образуется общая восьмиэлектронная оболочка.
За счёт большой разницы зарядов ядер, электроны в этой оболочке распределены неравномерно. Большая часть электронов находится около атома кислорода, что создаёт несимметричность молекулы. Молекула принимает вид равнобедренного треугольника с углом при вершине около 105 ⁰.

Несимметричность распределения заряда (говорят «полярность» молекулы) обуславливает способность воды образовывать межмолекулярные связи (называемые водородными). В результате у воды появляется ряд интересных свойств.
Свойства воды
Важнейшее свойство воды — способность растворять многие вещества. Молекулы веществ, попадая в раствор, окружаются полярными молекулами воды, которые препятствуют возвращению молекул в исходное тело, вещество начинает растворяться. В растворе молекулы веществ получается более «свободными», в результате становятся возможными многие химические реакции, которые не происходят между твёрдыми веществами.
Лимонная кислота и пищевая сода не реагируют друг с другом в виде порошков. Однако стоит залить смесь порошков водой — начнётся бурная реакция.
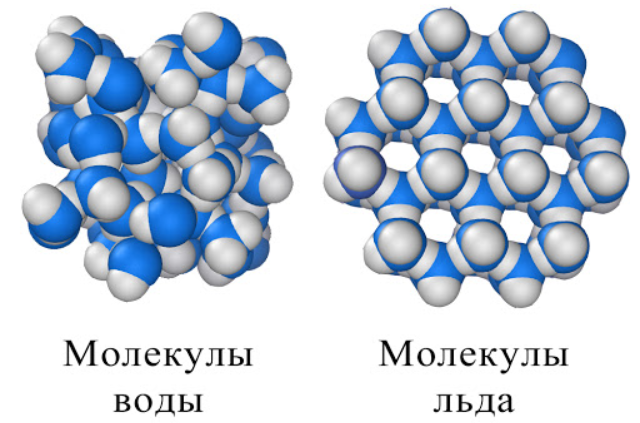
Более странное свойство демонстрирует вода при затвердевании. Из опыта все знают, что лёд плавает на поверхности воды, хотя большинство веществ в твёрдом состоянии увеличивают плотность. Следовательно, плотность льда меньше. Почему?
Дело опять в образовании водородных связей. При образовании льда молекулы воды образуют водородные связи и выстраиваются в «ажурную» структуру. Плотность льда оказывается меньше плотности воды.
Не менее удивительны тепловые свойства воды. Они также определяются водородными связями. На их построение и разрыв требуется дополнительная энергия, поэтому вода обладает аномально высокой теплоёмкостью и теплотой парообразования.
Значение воды для жизни
Комплекс свойств воды делает её незаменимой для существования жизни на Земле. Фактически живые существа являются «растворами», содержащимися в клетках-«пробирках» из белковых оболочек. В каждой «пробирке» идёт множество биохимических реакций при непосредственном участии воды.
Растения в процессе фотосинтеза из углекислого газа и воды синтезируют глюкозу и выделяют кислород. Однако атомы кислорода, выделяемые растениями, изначально входят в молекулы воды. Атомы кислорода, входящие в поглощённую молекулу углекислого газа, переходят в молекулы глюкозы и усваиваются растениями.


Что мы узнали?
Молекула воды состоит из атома кислорода и двух атомов водорода и способна к образованию связей, называемых водородными. Это в свою очередь определяет способность воды растворять другие вещества, иметь высокую теплоёмкость и малую плотность в твёрдом состоянии. Кроме того, без воды невозможна жизнь.
Тест по теме
- /5Вопрос 1 из 5
Из каких атомов состоит молекула воды?