Оксид азота


Средняя оценка: 4.5
Всего получено оценок: 338.
Средняя оценка: 4.5
Всего получено оценок: 338.
Известно десять оксидов азота, пять из которых находятся в стабильном состоянии. Атомы кислорода и азота во всех оксидах соединены ковалентной полярной химической связью.
Общее описание
Азот – это бесцветный двухатомный газ (N2). Атомы в молекуле азота удерживает прочная тройная связь, что обуславливает инертность элемента. Азот реагирует с другими элементами и соединениями под действием внешних факторов – высокой температуры, электричества, катализаторов.

Оксиды образуются из солей аммония и азотной кислоты. Формулы оксидов азота и краткая характеристика соединений приведены в таблице.
|
Название |
Формула |
Получение |
Особенности |
|
Оксид диазота или оксид азота (I) – «веселящий газ» |
N2O |
– Нагревание нитрата аммония (опасность взрыва): NH4NO3 → N2O + 2H2O; – нагревание аминосульфоновой кислоты с разбавленной азотной кислотой: NH2SO2OH + HNO3 → N2O + H2SO4 + H2O |
Бесцветный газ со сладковатым привкусом. Не горит, токсичен. Растворим в воде, серной кислота, спирте |
|
Монооксид или оксид азота (II) |
NO |
Единственный оксид, получаемый непосредственным взаимодействием кислорода и азота при температуре 1200°С или при электрических разрядах: N2 + O2 → 2NO |
Бесцветный ядовитый газ. На воздухе окисляется, приобретая коричневый цвет. Трудно сжижается. В жидком виде имеет голубой цвет |
|
Триоксид диазота или оксид азота (III) |
N2O3 |
При взаимодействии разбавленной азотной кислоты и твёрдого оксида мышьяка с последующим охлаждением: – 2HNO3 + As2O3 → NO2 + NO + 2HAsO3; – NO2 + NO → N2O3 |
При нормальных условиях – синяя жидкость. Может приобретать газообразное и твёрдое состояния. Сильно токсичен, вызывает ожоги кожи |
|
Диоксид или оксид азота (IV) |
NO2 |
– При взаимодействии азотной кислоты и меди: Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O; – при разложении нитрата свинца: 2Pb(NO3)2 → 2PbO + 4NO2 + O2 |
Ядовитый газ бурого цвета с острым запахом. Легко сжижается при температуре ниже +21°С, превращаясь в желтоватую жидкость |
|
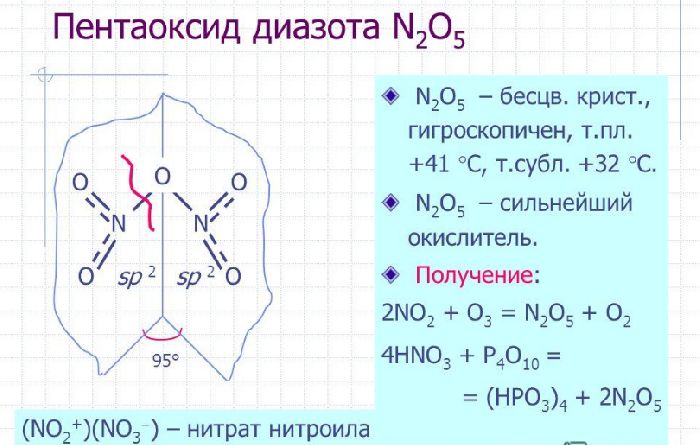
Пентаоксид диазота или оксид азота (V) |
N2O5 |
– Дегидратация азотной кислоты в присутствии оксида фосфора: 2HNO3 + P2O5 → 2HPO3 + N2O5; – взаимодействие хлора и нитрата серебра: 4AgNO3 + 2Cl2 → 4AgCl + 2N2O5 + O2; – реакция оксида азота (IV) и озона: 2NO2 + O3 → N2O5 + O2 |
Бесцветное твёрдое кристаллическое соединение, крайне неустойчивое при нормальных условиях. Приобретает стабильную форму при температуре ниже +10°C |

Помимо пяти стабильных оксидов азота известны ещё пять нестабильных соединений – NON3, NO2N3, N(NO2)3, нитратный радикал NO3 и димер, состоящий из двух простых молекул, диоксида азота (N2O4).
Химические свойства
Основные реакции оксидов азота с простыми и сложными веществами приведены в таблице.
|
Оксиды |
Реакции |
Уравнения |
|
N2O |
При нагревании разлагается. Окисляет неметаллы. Проявляет свойства восстановителя с сильными окислителями. Реагирует с аммиаком и его производными. Не образует солей. Не реагирует с водой, щелочами, кислотами |
– 2N2O → 2N2 + O2; – 2N2O + C → 2N2 + CO2; – 5N2O + 8KMnO4 + 7H2SO4 → 5Mn(NO3)2 + 3MnSO4 + 4K2SO4 + 7H2O; – 2NH3 + N2O → NH4N3 + H2O; – 2NaNH2 + N2O → NaN3 + NaOH + NH3 |
|
NO |
Окисляется до диоксида азота на воздухе при нормальных условиях. Взаимодействует с галогенами. В присутствии сильного восстановителя проявляет окислительные свойства. Не образует соли, плохо растворим в воде |
– 2NO + O2 → 2NO2; – 2NO + Cl2 → 2NOCl; – 2SO2 + 2NO → 2SO3 + N2 |
|
N2O3 |
Разлагается при нагревании. Реагирует с водой с образованием азотистой кислоты. Растворим в щелочах |
– N2O3 → NO + NO2; – N2O3 + H2O → 2HNO2; – N2O3 + 2KOH → 2KNO2 + H2O |
|
NO2 |
Реагирует с неметаллами, металлами, галогенами, водой. Окисляет оксиды серы. Растворяется в щелочах |
– 10NO2 + 8P → 4P2O5 + 5N2; – 4NO2 + Zn → Zn(NO3)2 + 2NO; – 2NO2 + 2Cl2 → NOCl + NO2Cl + Cl2O; – 2NO2 + H2O → HNO3 + HNO2; – NO2 + SO2 → SO3 + NO; – 2NO2 + 2KOH → KNO3 + KNO2 + H2O |
|
N2O5 |
Быстро разлагается с взрывом. Растворяется в воде, щелочах |
– 2N2O5 → 4NO2 + O2; – N2O5 + H2O ↔ 2HNO3; – N2O5 + 2NaOH → 2NaNO3 + H2O |
Оксиды используются для получения азотной кислоты. N2O используется в качестве наркоза.

Что мы узнали?
Из темы урока узнали, что азот может образовывать пять стабильных оксидов, проявляя переменную валентность I, II, III, IV, V. Только один оксид (NO) можно получить непосредственным взаимодействием азота и кислорода при нагревании или под воздействием электричества. Остальные оксиды выделяются из солей аммония и азотной кислоты. Большинство оксидов – токсичные газы, способные сжижаться. Оксиды реагируют с металлами, неметаллами, щелочами, оксидами.
Тест по теме
- /10Вопрос 1 из 10
Какой тип химической связи характерен для оксидов азота?